Жесткость воды – это свойство, обусловленное наличием в ней растворимых солей, в основном солей кальция и магния. Понятие жесткости воды принято связывать с катионами кальция Са2+ и в меньшей степени магния Mg2+. Оптимальная жесткость воды должна составлять 05-1,5- мг-экв/л. Повышенная жесткость воды свыше 4,5 мг-экв/л приводит к интенсивному накоплению осадка в системе, а образующаяся осадок мешает работе моющего оборудования. Поэтому водоподготовка и умягчение жесткой воды являются важными мероприятиями для сохранения работоспособности оборудования.
Жесткость воды разделяют на постоянную и временную. Постоянная жесткость воды обусловлена присутствием в воде сульфатов, хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2). Постоянную жесткость воды можно удалить путем пропускания через обратноосмотическую мембрану.
Временная жесткость (карбонатная жесткость воды) определяется наличием в воде гидрокарбонатов кальция и магния, которые и выпадают при нагреве( в бойлере при программе горячая вода) в осадок карбоната кальция (кальцит) или накипи. Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
Для умягчения жесткой воды с большим количеством солей жесткости применяют ионообменные смолы, способные поглощать соли жесткости. Ионообменные смолы подразделяются на катионообменные смолы (катиониты) и анионообменные смолы (аниониты). Умягчение воды методом ионного обмена через ионообменные смолы – это более дешевый метод, чем промышленный обратный осмос.
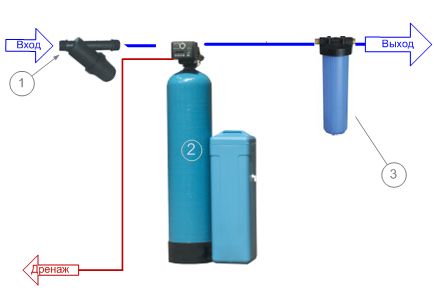
Ионообменный фильтр для умягчения воды – один из наиболее распространенных сегодня способов повышения качества воды. Применяемая здесь технология позволяет заместить атомы кальция и магния, придающие воде жесткость, на атомы натрия, которые не обладают подобным действием.
ИОННЫЙ ОБМЕН
Ионообменные смолы представляет собой скопление достаточно мелких шариков, изготовленных из специальных полимерных материалов и именуемых для простоты катиониты или аниониты. Для неискушенного человека внешне такая смола может напомнить щучью или минтаевую икру. Однако, эта «икра» обладает уникальными свойствами. Шарики смолы способны улавливать из воды ионы различных веществ, в том числе и соли жесткости, и, впитывать их в себя отдавать взамен запасенные ранее ионы, обычно ионы натрия Na+ или водорода Н+. В таком случае это катионообменные смолы (катиониты). В обратном случае анионообменные смолы поглощают ионы хлора Cl- (аниониты). Таким образом осуществляется ионный обмен, т.е. умягчение воды методом ионного обмена, — отсюда и обобщающее название — «ионообменные смолы» или более по научному «иониты».
ПРЕИМУЩЕСТВА ИОННОГО ОБМЕНА
Главным преимуществом ионного обмена является тот факт, что иониты могут удалять из воды железо, находящееся в растворенном состоянии. Умягчающие иониты способны поглощать соли жесткости. Когда происходит насыщение солями жесткости, ионообменные смолы подлежат регенерации.
Катиониты и аниониты можно регенерировать многократно, затем ионообменные соли подлежат замене.
Благодаря ионному обмену из воды можно удалять ионы металлов, например растворенное железо. Они способны поглощать соли жесткости, но до некого предела, когда происходит насыщение. После этого ионообменные смолы требуют регенерации.
Катиониты и аниониты можно регенерировать многократно, затем ионообменные смолы подлежат замене. Средний срок их службы порядка 2 лет.